獨協医科大学化学2012年第2問
次の文章を読み、下の問1~6に答えなさい。〔解答番号$\fbox{1}$~$\fbox{6}$〕
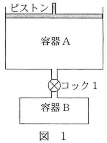
二酸化炭素の水に対する溶解度を求めるため、図1のような装置を組んだ。温度は7℃で一定である。容器Aには二酸化炭素が封入されており、容器Bは300mLの水によって満たされている。容器Aのピストンに、常に$2.0\times10^5$Paの圧力がかかるようにしてコック1を開けて放置すると、容器A中の気体の体積が0.36Lだけ減少したところで、ピストンの降下は停止した。ただし、気体の溶解についてはヘンリーの法則が成立し、酸素の水への溶解や水の蒸発、また、容器と容器をつなぐ管の内容積は無視できるものとする。

- 問1 この実験より、二酸化炭素は、7℃、$1.0\times10^5$Paで水1.0Lに何L溶けることがわかるか。最も近い数値を、次の(1)~(6)のうちから一つ選びなさい。$\fbox{1}$L
- (1) 0.18
- (2) 0.36
- (3) 0.54
- (4) 0.60
- (5) 0.82
- (6) 1.2

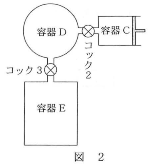
- 問2 状態1において、容器D中の二酸化炭素の分圧は何Paになっているか。最も近い数値を、次の(1)~(6)のうちから一つ選びなさい。$\fbox{2}$Pa
- (1) $1.0\times10^4$
- (2) $1.5\times10^4$
- (3) $2.0\times10^4$
- (4) $3.0\times10^4$
- (5) $5.0\times10^4$
- (6) $8.0\times10^4$
- 問3 状態2において、容器中の二酸化炭素の全物質量に対する、気体状態の二酸化炭素の物質量の割合は何%か。最も近い数値を、次の(1)~(6)のうちから一つ選びなさい。$\fbox{3}$%
- (1) 25
- (2) 33
- (3) 40
- (4) 46
- (5) 52
- (6) 67
- 問4 状態2において、気体状態の二酸化炭素の分圧は何Paになっているか。最も近い数値を、次の(1)~(6)のうちから一つ選びなさい。$\fbox{4}$Pa
- (1) $4.0\times10^3$
- (2) $4.7\times10^3$
- (3) $5.1\times10^3$
- (4) $5.6\times10^3$
- (5) $6.1\times10^3$
- (6) $6.8\times10^3$
- 問5 状態2において、容器中の水1.0Lあたりに溶解している二酸化炭素の体積を、標準状態に換算すると何mLになるか。最も近い数値を、次の(1)~(6)のうちから一つ選びなさい。ただし、標準状態における気体1molの体積を22.4Lとする。$\fbox{5}$mL
- (1) 42
- (2) 46
- (3) 52
- (4) 58
- (5) 66
- (6) 74
- 問6 状態2における容器Dの圧力は何Paになっているか。最も近い数値を、次の(1)~(6)のうちから一つ選びなさい。$\fbox{6}$Pa
- (1) $1.2\times10^4$
- (2) $2.2\times10^4$
- (3) $3.8\times10^4$
- (4) $5.7\times10^4$
- (5) $8.9\times10^4$
- (6) $9.1\times10^4$