兵庫医科大学化学2013年第1問
窒素は植物の生育に必須の元素である。しかし、植物は窒素を大気中に存在する$\text{N}_2$の形では利用できない。植物が直接利用できる窒素化合物は、主に死んだ動植物の微生物による分解物や大気中で生成する物質に依存している。肥料がいつから農耕に用いられたかは不明だが、糞尿や食物残渣を土に混ぜると植物の生育が良くなることが経験的に知られ、これらは天然肥料として用いられていた。19世紀に入り、人口増加による食料増産の要求が高まり、肥料、特に窒素肥料の需要が増大した。そこで、(a)石炭を乾留(空気を遮断して加熱分解すること)する際に生じるアンモニアガスを硫酸に吸収させて作られていた副生硫安(硫酸アンモニウム)が肥料としてまず利用された。ついで、南米から産出するチリ硝石(硝酸ナトリウム)が肥料として使われた。なお、チリ硝石から精製される硝酸ナトリウムは火薬類の原料にも利用されたため、チリ硝石の採掘が盛んになっていった。そのため、天然資源の枯渇が危惧されたので、人工的に窒素固定する方法がいくつか考案されたが、なかなか実用化には至らなかった。ようやく20世紀初頭に、(b)ハーバーとボッシュがアンモニアの工業的生産法を確立し、窒素肥料の増産が可能になった。現在でもアンモニア工業生産量の約8割は肥料用として、それ以外は基礎化学薬品の原料等として用いられている。
近年、炭素化合物に代わるエネルギー源としてアンモニアを利用する研究が進められている。その一つのアンモニア燃料電池は、アンモニアが燃焼するときの酸化還元反応で得られる反応熱(熱エネルギー)を電気エネルギーとして取り出す装置である。この電池では、(c)一方の電極ではアンモニアと水酸化物イオンとの反応で窒素と水が生成し、もう一方の電極では酸素と水の反応で水酸化物イオンが生成する。全体の化学反応は<1>式で示される。
\[\text{NH}_3+\dfrac{3}{4}\text{O}_2\longrightarrow\dfrac{3}{2}\text{H}_2\text{O}+\dfrac{1}{2}\text{N}_2\tag{A}\label{aa}\]コストや窒素酸化物の副生などの問題が解消されれば、アンモニア燃料電池の実用化にかかる期待は大きい。何しろ原料の窒素は空気中に無尽蔵に存在するのである。
- (1)植物が直接利用できる窒素原子を含むイオンの化学式を2つ書け。
- (2)日本の農家には「雷が多い年は豊作になる」という言い伝えがある。この言い伝えが正しいとして、降水量や気温以外で考えられるその理由を説明せよ。
- (3)下線部(a)のように、ある種の石炭を乾留するとその質量の0.20%のアンモニアガスが得られる。この石炭1.0kgから得られる硫酸アンモニウムの質量(g)を有効数字2桁で求めよ。計算の過程も示すこと。
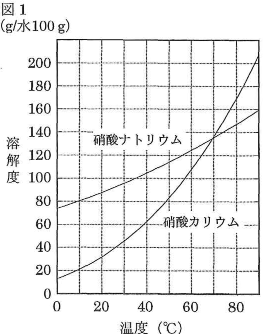
- (4)図1は硝酸ナトリウムと硝酸カリウムの溶解度曲線である。次の文章中の$\fbox{ア}$~$\fbox{オ}$に適当な整数を入れよ。ただし、一方の塩の存在によって他方の塩の溶解度は影響を受けず、加熱による水の蒸発はないものとする。
実験室に、水100gの入ったビーカー、硝酸ナトリウムと硝酸カリウムの混合物(質量比$\text{NaNO}_3:\text{KNO}_3=2:1$)、バーナー、ビーカーを冷やすための水が入ったバケツがある。なお、水の温度は10℃から80℃までの範囲しか保つことができないものとする。
硝酸ナトリウムと硝酸カリウムのいずれについても不溶物のない飽和溶液を作成したい場合は、ビーカーの温度を$\fbox{ア}$℃にして混合物を適量加えればよい。この飽和溶液を10℃に冷却すると$\fbox{イ}$gの結晶が析出する。一方、混合物から、より多くの純粋な硝酸ナトリウムを得たい場合は、まず$\fbox{ウ}$℃に熱したビーカーに混合物を適量加えて完全に溶解させる。次に、この溶液をゆっくり$\fbox{エ}$℃に冷却すると$\fbox{オ}$gの硝酸ナトリウムの結晶が析出するので、これをろ過すればよい。
- (5)下線部(b)について、次の中から正しい記述をすべて選び、記号で答えよ。
- a.白金を主成分とする触媒を使用する。
- b.触媒を使用することによって、反応熱を小さくして装置の耐久性を増強している。
- c.触媒を使用することによって、アンモニアが生成する向きに平衡を移動させている。
- d.耐熱性の反応容器内でなるべく温度を上げることによって、アンモニアが生成する向きに平衡を移動させている。
- e.耐圧性の反応容器内でなるべく圧力を上げることによって、アンモニアが生成する向きに平衡を移動させている。
- f.アンモニアを冷却して液化させることによって、アンモニアが生成する向きに平衡を移動させている。
- (6)下線部(c)について、正極および負極でおこる反応を、電子e-を含むイオン反応式でそれぞれ表せ。
- (7)$\eqref{aa}$式の反応熱は381kJ/molである。アンモニア燃料電池の起電力を1.1Vにするためには、エネルギー変換効率を少なくとも何%にする必要があるか。次の中から選び、記号で答えよ。ただし、1.0Jは1.OC・Vであり、ファラデー定数は$9.6\times10^4$C/molとする。
- a.25%
- b.35%
- c.45%
- d.55%
- e.65%
- f.75%
- g.85%
- h.95%