兵庫医科大学化学2012年第1問
マンガンに関する設問(1)~(3)に答えよ。
- (1) マンガンは軟マンガン鉱$(\text{MnO}_2)$などの酸化物として産出される。図1は軟マンガン鉱結晶の単位格子を表している。この図では、原子Aは単位格子内と単位格子境界面に位置し、原子Bは単位格子内と単位格子頂点上に位置している。
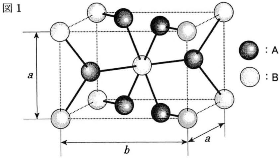
- (i) マンガンの原子は図1のAとBのいずれか。
- (ii) 単位格子の一辺の長さを$a$(m)と$b$(m)、$\text{MnO}_2$の式量を$M$、アボガドロ定数を$N_{\text{A}}$(/mol)とするとき、結晶の密度(g/cm3)をこれらの記号等を用いて表せ。
- (2) 図2のような装置を組んで、(a)0.50gの酸化マンガン(IV)に濃塩酸を加えて加熱し、発生した塩素を捕集した。次に、捕集した塩素をヨウ化カリウム溶液に溶解させ、すべての塩素を塩化カリウムに変換させた。この溶液にデンプン溶液を数滴加えてから、(b)0.50mol/Lチオ硫酸ナトリウム溶液を滴下していったところ、22mL加えたところで溶液の青色が消失した。
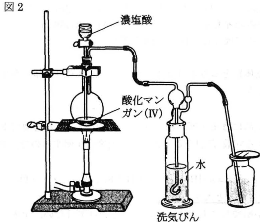
- (i) 下線部(a)、(b)の操作で進行している反応の化学反応式を書け。ただし、チオ硫酸ナトリウム$\text{Na}_2\text{S}_2\text{O}_3$が水溶液中で還元剤としてはたらくときは次式のように電子を失う。 \[2\text{S}_2{\text{O}_3}^{2-}\rightarrow\text{S}_4{\text{O}_6}^{2-}+2\text{e}^-\]
- (ii) 洗気びんの水は揮発した塩化水素を除くために用いている。塩素は水にわずかしか溶けないが、塩化水素を含む水への溶解度はさらに小さくなる。その理由を説明せよ。
- (iii) 洗気びんで水に溶解した塩素(mL)を標準状態に換算して有効数字2桁で求めよ。原子量は$\text{O}=16$、$\text{Mn}=55$とし、計算の過程も示すこと。ただし、酸化マンガン(IV)はすべて反応で消費され、洗気びん以外での塩素の損失はないものとする。
- (3) 図3はマンガン乾電池の原型であるルクランシェ電池を表している。この電池の負極では亜鉛が電子を放出して亜鉛イオンになるが、塩化アンモニウムの飽和溶液中なので、亜鉛とアンモニアからなる正四面体構造の錯イオンが形成される。そのため、負極表面の亜鉛イオンが取り除かれ、亜鉛のイオン化が円滑になる。一方、正極で電子を受け取る水素イオンは直ちに酸化マンガン(IV)によって酸化される。
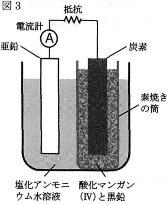
- (i) 図のように正極の周囲を酸化剤で覆うことの利点を書け。
- (ii) この電池を1時間放電したところ、平均1.0Aの電流が流れた。このとき、錯イオンに取り込まれたアンモニア分子の個数を有効数字2桁で求めよ。アボガドロ定数は$6.0\times10^{23}$/mol、ファラデー定数は$9.6\times10^4$C/molとし、計算の過程も示すこと。ただし、負極で生じた亜鉛イオンはすべて錯イオンになったものとする。