順天堂大学化学2012年第5問
イオン化傾向が最も大きな金属として、リチウム(Li)が知られている。同じ金属が正極であった時、リチウムを負極に用いると最も大きな起電力が得られる。それを利用したのがリチウム電池であり、現在ボタン電池などとして幅広く用いられている。リチウム電池の代表的なものは金属リチウムと二酸化マンガンをそれぞれ負極、正極とし、電解質としてはリチウム塩を用い、また電解液としてリチウム塩を溶解できる有機溶媒を用いている。リチウム電池に関する次の各問いに答えなさい。
- 問1 この電池が電解液として有機溶媒を用いる理由を30字以内で記しなさい。
- 問2 電池の性能は、起電力の他に取り出せる電気量(放電容量)も大切な要素となる。基本的には電極の単位重量あたりできるだけ多くの電子の出し入れが出来る物質が電極材料として優れている。リチウムはその点でも優れた電極材料である。放電容量の表示法として、$X$アンペアの電流を1時間流せる量で示す方法があり、$X$ [Ah]と表す。今、負極に用いられたリチウムが電池全体の放電容量を決めているとし、その電極反応が完全に進行するものと仮定する。その時の理論的に取り出せる放電容量は、リチウム1.0 gでは何Ahとなるか。有効数字2桁で示しなさい。
- 問3 ダニエル電池において、問2と同じように負極の亜鉛が電池全体の放電容量を決めているとし、電極反応が完全に進行するものと仮定する。その時に理論的に取り出せる放電容量は亜鉛1.0 gではリチウムの何倍であるか。有効数字2桁で示しなさい。
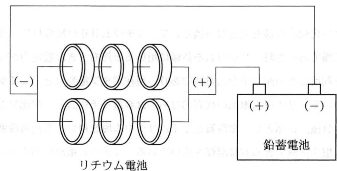
- 問4 図の様に3個のリチウム電池を直列につないだものを、互いに並列に2列にした回路を作り、鉛蓄電池の充電を試みた。一定時間充電したところ、鉛蓄電池の電解質中の硫酸質量が1.96g増加した。この時、回路中のリチウム電池1個あたり、リチウムの質量は何mg減少したか。有効数字2桁で示しなさい。ただし、各電池での反応は100%の効率で進むものとする。
