川崎医科大学化学2013年第2問
各問いに答えよ。
- [1] アルカリ金属元素とハロゲン元素からなる物質はどれか。一つ選べ。$\fbox{ア}$
- (1)$\text{MgO}$
- (2)$\text{Na}_2\text{O}$
- (3)$\text{KBr}$
- (4)$\text{CaCl}_2$
- (5)$\text{AgBr}$
- (6)$\text{AlCl}_3$
- [2] 二つの原子が同位体の関係にあることを示す記述として正しいのはどれか。二つ選び、$\fbox{イ}$に二つマークせよ。$\fbox{イ}$
- (1)陽子の数は等しいが、質量数は異なる。
- (2)陽子の数は異なるが、質量数は等しい。
- (3)原子番号は等しいが、中性子の数は異なる。
- (4)原子番号は異なるが、中性子の数は等しい。
- (5)原子番号は等しいが、電子の数は異なる。
- (6)原子番号は異なるが、電子の数は等しい。
- (7)陽子の数と中性子の数の和が等しい。
- [3] 金(原子量197)は海水1L中に、$2\times10^{-10}$ g含まれている。このとき、金原子は1cm3に$\fbox{ウ}\times10^{\fbox{エ}\fbox{オ}}$個の割合で存在することになる。$\fbox{ウ}$~$\fbox{オ}$に数値を入れよ。ただし、金は海水中に一様に存在しているものとする。
- [4] 標準状態において、メタンとプロパンの混合気体が11.2Lある。この混合気体を完全燃焼させると、51.2gの酸素が反応した。混合気体中のメタンとプロパンの物質量比を最も単純な整数で表せ。$\fbox{カ}$、$\fbox{キ}$に数値を入れよ。
メタン:プロパン=$\fbox{カ}$:$\fbox{キ}$ - [5] 水酸化ナトリウム(モル質量40g/mol)$a$〔g〕を水に溶かして全量を1Lにした水溶液がある。この水溶液で7gの硫酸(モル質量98g/mol)を中和した。用いた水酸化ナトリウム水溶液の体積(L)を求めよ。次の$\fbox{ク}$$\fbox{ケ}$および$\fbox{コ}$の部分には約分した結果の数値を入れて式を完成せよ。 $必要な水酸化ナトリウム水溶液の体積=\dfrac{\fbox{ク}\fbox{ケ}}{\fbox{コ}}・\dfrac{1}{a}〔L〕$
- [6] 次の文を読み、問いに答えよ。
図のように、塩化アンモニウムと水酸化カルシウムの混合物を試験管に入れ、加熱して発生した気体を集めた。ただし、気体の乾燥および捕集を行う部分については省略して描いている。
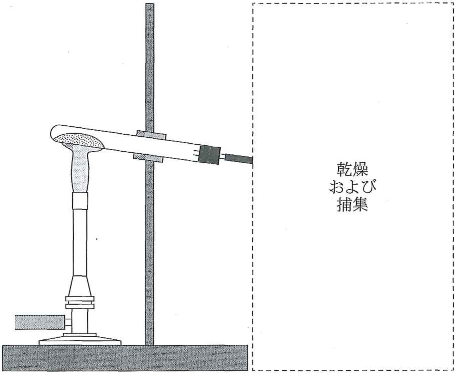
- 1)試験管の口を下げているのはなぜか。一つ選べ。$\fbox{サ}$
- (1)急激な加熱を防ぐため
- (2)混合物の反応効率を高めるため
- (3)生じた水滴が加熱部分に流れるのを防ぐため
- (4)発生した気体を効率よく試験管の外に出すため
- 2)発生した気体の乾燥には何を用いるか。一つ選べ。$\fbox{シ}$
- (1)塩化カルシウム
- (2)十酸化四リン
- (3)ソーダ石灰
- (4)炭酸カルシウム
- (5)濃硫酸
- 3)誤っているのはどれか。二つ選び、$\fbox{ス}$に二つマークせよ。$\fbox{ス}$
- (1)発生した気体は無臭である。
- (2)発生した気体は無色である。
- (3)発生した気体は下方置換で捕集する。
- (4)発生した気体を水に溶かすと、アルカリ性を示す。
- (5)発生した気体に濃塩酸をつけたガラス棒を近づけると、白煙が生じる。
- 4)この気体の工業的製法はどれか。一つ選べ。$\fbox{セ}$
- (1)ハーバー・ボッシュ法
- (2)オストワルト法
- (3)アンモニアソーダ法
- (4)クメン法
- (5)隔膜法
- 1)試験管の口を下げているのはなぜか。一つ選べ。$\fbox{サ}$
- [7] 分子式$\text{C}_5\text{H}_{12}\text{O}$で表される次のアルコールについて、問いに答えよ。
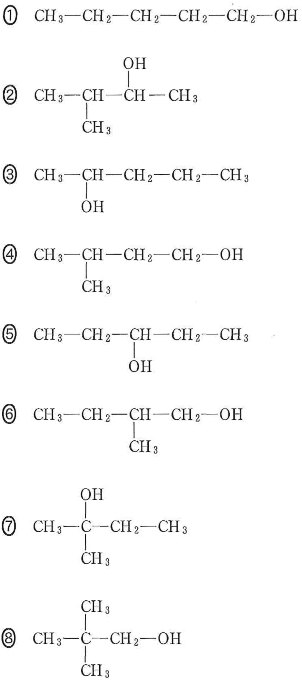
- 1)不斉炭素原子をもつのはどれか。三つ選び、$\fbox{ソ}$に三つマークせよ。$\fbox{ソ}$
- 2)分子内の脱水反応が起きないのはどれか。一つ選べ。$\fbox{タ}$
- 3)第三級アルコールはどれか。一つ選べ。$\fbox{チ}$
- [8] $\fbox{ツ}$~$\fbox{ヌ}$に、最も適切なものを一つずつ選べ。
エタノール分子は極性のある$\fbox{ツ}$基と極性のない$\fbox{テ}$基をもつ。$\fbox{ツ}$基は$\fbox{ト}$であり、この部分で水分子と$\fbox{ナ}$結合をつくる。一方、$\fbox{テ}$基のように水和されにくい基を$\fbox{ニ}$という。この$\fbox{テ}$基の炭素数が多いアルコールでは水への溶解度は低下する。
ヨウ素は極性をもたない分子であり、水に入れても水和が起こらないために溶解しないが、$\fbox{ヌ}$などの無極性溶媒に溶けやすい。
$\fbox{ツ}$、$\fbox{テ}$の選択肢- (1)ヒドロキシ
- (2)ビニル
- (3)カルボキシル
- (4)アルデヒド
- (5)ケトン
- (6)アルキル
- (1)水素
- (2)イオン
- (3)共有
- (4)エステル
- (5)エーテル
- (6)親水基
- (7)疎水基
- (1)エタノール
- (2)ベンゼン
- (3)塩化水素
- (4)酢酸
- [9] 次の文を読み、問いに答えよ。
体積1Lの容器に水素$\text{H}_2$とヨウ素$\text{I}_2$をそれぞれ濃度$1.0\times10^{-2}$mol/Lになるように容器に入れで、ある温度に保ったところ、時間$t_e$経過後は式(a)の反応が平衡状態になっていた。 \[\text{H}_2(気)+\text{I}_2(気)\rightleftarrows2\text{HI}(気)\tag{a}\label{aa}\] 図は平衡状態に達するまでの$\text{H}_2$、$\text{I}_2$および$\text{HI}$の濃度変化を示している。
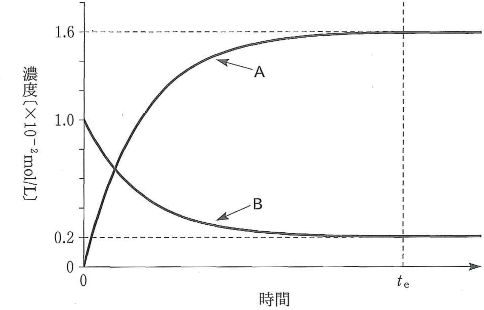
- 1)$\text{H}_2$、$\text{I}_2$および$\text{HI}$の濃度変化は曲線AまたはBのどちらか。正しい組合せを一つ選べ。$\fbox{ネ}$
$\text{H}_2$の濃度変化 $\text{I}_2$の濃度変化 $\text{HI}$の濃度変化 (1) A A A (2) A A B (3) A B A (4) A B B (5) B A A (6) B A B (7) B B A (8) B B B - 2)式$\eqref{aa}$において、正反応の反応速度(単位時間に生成する$\text{HI}$の分子数)を$v_1$、逆反応の反応速度(単位時間に分解する$\text{HI}$の分子数)を$v_2$としたとき、反応速度についての記述として正しいのはどれか。二つ選び、$\fbox{ノ}$に二つマークせよ。$\fbox{ノ}$
- (1)$v_1$は最初が最も大きい。
- (2)$v_2$は最初が最も大きい。
- (3)時間$t_e$において$v_1$は0である。
- (4)時間$t_e$において$v_2$は0である。
- (5)時間$t_e$において$v_1=v_2$である。
- (6)時間$t_e$において$v_1$は$v_2$の2倍である。
- (7)時間$t_e$において、$v_2$は$v_1$の2倍である。
- 1)$\text{H}_2$、$\text{I}_2$および$\text{HI}$の濃度変化は曲線AまたはBのどちらか。正しい組合せを一つ選べ。$\fbox{ネ}$
- [10] 次の文を読み、問いに答えよ。
酸化マンガン(Ⅳ)に過酸化水素水を加えて酸素を発生させ、水上置換により捕集したところ、27℃で、830mLの気体が得られた。このとき、捕集瓶の内と外の水面は一致していた。ただし、大気圧は$1.013\times10^5$Pa、27℃における水の蒸気圧は$3.6\times10^3$Paとする。
- 1)酸素の分圧は何Paか。最も近い値を一つ選べ。$\fbox{ハ}$Pa
- (1)$9.41\times10^4$
- (2)$9.77\times10^4$
- (3)$1.05\times10^5$
- (4)$1.09\times10^5$
- (5)$1.11\times10^5$
- 2)捕集した気体に含まれる酸素の質量は何gか。最も近い値を一つ選べ。$\fbox{ヒ}$g
- (1)0.52
- (2)1.04
- (3)1.56
- (4)3.12
- (5)6.24
- 1)酸素の分圧は何Paか。最も近い値を一つ選べ。$\fbox{ハ}$Pa
- [11] マルトース水溶液50mLにマルターゼを加えて完全に加水分解した。これに過剰のフェーリング液を加えて加熱したところ、酸化銅(Ⅰ)(モル質量143g/mol)の赤色沈殿0.715gを得た。もとのマルトース水溶液の濃度は何mol/Lか。最も近い値を一つ選べ。ただし、アルデヒド基を一つもつ単糖にフェーリング液を加えて加熱すると、単糖1molに対して1molの$\text{Cu}_2\text{O}$が生成する。$\fbox{フ}$mol/L
- (1)$2.5\times10^{-3}$
- (2)$5.0\times10^{-3}$
- (3)$1.0x10^{-2}$
- (4)$2.0\times10^{-2}$
- (5)$3.0\times10^{-2}$
- (6)$5.0\times10^{-2}$