川崎医科大学化学2012年第1問
計算に必要なら次の数値を用いよ。
- 原子量: $\text{H}~1$、$\text{C}~12$、$\text{N}~14$、$\text{O}~16$、$\text{F}~19$、$\text{Na}~23$、$\text{Mg}~24$、$\text{Al}~27$、$\text{Si}~28$、$\text{P}~31$、$\text{S}~32$、$\text{CI}~35.5$、$\text{K}~39$、$\text{Ca}~40$、$\text{Cr}~52$、$\text{Fe}~56$、$\text{Cu}~63.5$、$\text{Zn}~65.4$、$\text{Br}~80$、$\text{Ag}~108$、$\text{I}~127$
- アボガドロ定数:$6.0\times10^{23}/\text{mol}$
- ファラデ一定数:$9.65\times10^4 \text{C/mol}$
- 気体定数:$8.3\times10^3\text{Pa}\cdot\text{L/(K}\cdot\text{mol)}=8.3\text{J/(K}\cdot\text{mol)}=0.082\text{atm}\cdot\text{L/(K}\cdot\text{mol)}$
- 標準大気圧:$1.01\times10^5\text{Pa}$
- 対数:$\log_{10}2=0.30$、$\log_{10}3=0.48$、$\log_{10}7=0.85$
体積の単位リットルの記号は大文字の$\text{L}$を用いている。
- 各問いに答えよ。
- (1) 1)、2)に当てはまるものを、それぞれ二つずつ選び、$\fbox{ア}$、$\fbox{イ}$に二つずつマークせよ。
- 1) 単体であるもの$\fbox{ア}$
- 2) 混合物であるもの$\fbox{イ}$
- (1) 塩酸
- (2) 海水
- (3) 黒鉛
- (4) 水酸化ナトリウム
- (5) ダイヤモンド
- (6) 硫酸銅(Ⅱ)五水和物
- (2) アデノシン三リン酸(ATP)に関して正しいのはどれか。二つ選び、$\fbox{ウ}$に二つマークせよ。
- (1) 糖を含む。
- (2) アミノ酸を含む。
- (3) 脂肪酸を含む。
- (4) ビタミンを含む。
- (5) 金属を含む。
- (6) 塩基を含む。
- (3) 質量パーセント濃度が$A\text{%}$の過酸化水素水$B\text{g}$に酸化マンガン(Ⅳ)を加えたとき、発生する気体の体積は、標準状態で何$\text{L}$か。一つ選べ。ただし、反応は完全に進行するものとする。 $\fbox{エ}\text{L}$
- (1) $\dfrac{17}{50AB}$
- (2) $\dfrac{17}{1600AB}$
- (3) $\dfrac{17}{112AB}$
- (4) $\dfrac{112AB}{17}$
- (5) $\dfrac{2}{425AB}$
- (6) $\dfrac{2AB}{425}$
- (7) $\dfrac{4}{425AB}$
- (8) $\dfrac{4AB}{425}$
- (9) $\dfrac{7AB}{2125}$
- (10) $\dfrac{119}{AB}$
- (4) 次のエネルギー図に関して誤っているのはどれか。 一つ選べ。$\fbox{オ}$
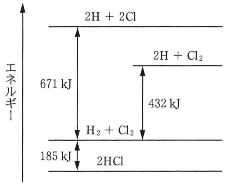
- (1) 塩化水素の生成熱は$92.5\text{kJ/mol}$である。
- (2) $\text{H}-\text{Cl}$の結合エネルギーは$428\text{kJ/mol}$である。
- (3) $\text{H}-\text{H}$の結合を一つ切断すると$7.2\times10^{-19}\text{J}$のエネルギーが放出される。
- (4) $\text{Cl}_2$の結合を切断して塩素原子$1.0\text{mol}$を得るには$119.5\text{kJ}$のエネルギーが必要である。
- (5) $\text{H}_2$と$\text{Cl}_2$を反応させて塩化水素$1.46\text{g}$を生成させると$3.7\text{kJ}$のエネルギーが放出される。
(5) 水に溶けている酸素02の量を測定する次の方法を読み、l)~3)に答えよ。
試料水に、硫酸マンガン(II)$\text{MnSO}_4$水溶液と水酸化ナトリウム水溶液を加えると、水酸化マンガン(II)$\text{Mn(OH)}_2$の沈殿が生じる(式$\eqref{aa}$)。 \[\text{MnSO}_4+2\text{NaOH}\rightarrow \text{Mn(OH)}_2+\text{Na}_2\text{SO}_4 \tag{a}\label{aa}\] 水酸化マンガン(II)は、水中の酸素に対応する量だけが酸化され、$\text{MnO(OH)}_2$が沈殿する(式$\eqref{ab}$)。 \[2\text{Mn(OH)}_2+\text{O}_2\rightarrow2\text{MnO(OH)}_2 \tag{b}\label{ab}\] この$\text{MnO(OH)}_2$の沈殿は、酸性条件下でヨウ化物イオンと反応してヨウ素$\text{I}_2$を生じる(式$\eqref{ac}$)。 \[\text{MnO(OH)}_2+2\text{I}^-+4\text{H}^+\rightarrow\text{Mn}^{2+}+\text{I}_2+3\text{H}_2\text{O} \tag{c}\label{ac}\] 式$\eqref{ac}$で生じたヨウ素を、濃度のわかっているチオ硫酸ナトリウム水溶液で滴定することで、試料水に溶けていた酸素の量を求めることができる。このとき、ヨウ素とチオ硫酸ナトリウムは式$\eqref{ad}$のように反応する。 \[\text{I}_2+2\text{S}_2\text{O}_3^{2-}\rightarrow 2\text{I}^-+\text{S}_4\text{O}_6^{2-}\tag{d}\label{ad}\]- 1) 式$\eqref{ab}$で生じる$\text{MnO(OH)}_2$において、マンガン原子の酸化数はいくらか。$\fbox{カ}$には$+$または$-$を、$\fbox{キ}$には数値を入れよ。$\fbox{カ}\fbox{キ}$
- 2) 式$\eqref{ac}$で生じるヨウ素$\text{I}_2$の物質量は、試料水中に存在した酸素$\text{O}_2$の物質量の何倍か。一つ選べ。$\fbox{ク}$倍
- (1) $\frac{1}{4}$
- (2) $\frac{1}{3}$
- (3) $\frac{1}{2}$
- (4) $1$
- (5) $2$
- (6) $3$
- (7) $4$
- 3) ヨウ素の量を求める滴定に$0.025\text{mol/L}$チオ硫酸ナトリウム水溶液を用いた場合、その$1\text{mL}$は試料水中の酸素$\text{O}_2$何$\text{mg}$に相当するか。 四捨五入により小数第2位まで求め、数値を入れよ。
$\fbox{ケ}.\fbox{コ}\fbox{サ}\text{mg}$
- (6) 3種類の同族元素を原子番号の小さい順に示している。$\fbox{シ}$~$\fbox{セ}$の元素の説明として最も適するものを、それぞれ一つずつ選べ。
- $\text{C}-\fbox{シ}-\text{Ge}$
- $\fbox{ス}-\text{Ag}-\text{Au}$
- $\text{Mg}-\text{Ca}-\fbox{セ}$
- (1) 水素化合物の水溶液は石英やガラスなどを溶かす。
- (2) 単体はダニエル電池の正極板に使われる。
- (3) 陽イオンは$\text{He}$と同じ電子配置をもつ。
- (4) 酸化物は無色、剌激臭で、人体に有害な気体である。
- (5) 酸化物は酸とも塩基とも反応して塩を生じる。
- (6) 単体は半導体の材料として用いられる。
- (7) 硫酸塩はセッコウの成分である。
- (8) 炎色反応の色は赤(紅)色である。
- (9) 炎色反応の色は黄色である。
- (7) 正しいのはどれか。一つ選べ。$\fbox{ソ}$
- (1) アルカリ金属は遷移元素である。
- (2) 鉄、銅、マグネシウムは、いずれも遷移元素である。
- (3) 遷移元素を含む化合物は全て無色である。
- (4) 水銀は亜鉛よりもイオン化傾向が小さい。
- (5) 遷移元素の原子の酸化数は+5以上にならない。
(8) 問いに答えよ。
濃硫酸は無色でねばりけのある液体で、吸湿性が強く乾燥剤に用いられる。加熱した濃硫酸(熱濃硫酸)は強い$\fbox{タ}$作用を示す。この作用によって、銅や銀を溶かして$\fbox{チ}$を発生する。濃硫酸には濃塩酸のような強い剌激臭がない。これは濃硫酸$\underline{(a)\fbox{ツ}性}$だからである。(b)希硫酸は水素よりイオン化傾向の大きい金属を溶かす。
硫酸の工業的製法では、まず硫黄を燃焼させて$\fbox{テ}$をつくる。 次に$\fbox{テ}$を触媒存在下で空気と反応させて$\fbox{ト}$を得る。 得られた$\fbox{ト}$を水と反応させて硫酸にする。(c)この製法を$\fbox{ナ}$法という。
- 1) $\fbox{タ}$~$\fbox{ト}$には【A群】から、$\fbox{ナ}$には【B群】から最も適するものを一つずつ選べ。重複して選んでよい。
【A群】- (1) 水 素
- (2) 二酸化硫黄
- (3) 三酸化硫黄
- (4) 硫化水素
- (5) 揮発
- (6) 不揮発
- (7) 強酸
- (8) 脱 水
- (9) 酸化
- (10) 還元
- (1) オストワルト
- (2) ソルベー
- (3) ハーバー・ボッシュ
- (4) 触媒
- (5) 接触
- (6) 蒸留
- 2) (a)の性質によって起こる反応はどれか。最も適当なものを一つ選べ。$\fbox{ニ}$
- (1) $\text{C}_{12}\text{H}_{22}\text{O}_{11}\xrightarrow{\text{H}_2\text{SO}_4}12\text{C}+11\text{H}_2\text{O}$
- (2) $\text{NaCl}+\text{H}_2\text{SO}_4\rightarrow\text{NaHSO}_4+\text{HCl}$
- (3) $\text{Zn}+\text{H}_2\text{SO}_4\rightarrow\text{ZnSO}_4+\text{H}_2$
- (4) $2\text{NaOH}+\text{H}_2\text{SO}_4\rightarrow\text{Na}_2\text{SO}_4+2\text{H}_2\text{O}$
- (5) $\text{FeS}+\text{H}_2\text{SO}_4\rightarrow\text{FeSO}_4+\text{H}_2\text{S}$
- 3) (b)の希硫酸を濃硫酸からつくるときの操作の組合せとして正しいのはどれか。一つ選べ。$\fbox{ヌ}$
- a 濃硫酸に水を加えて希釈する。
- b 水に濃硫酸を加えて希釈する。
- c 冷却しながら希釈する。
- d 加温しながら希釈する。
- e 攪拌しながら希釈する。
- f 攪拌せずに静置して希釈する。
- (1) a、c、e
- (2) a、c、f
- (3) a、d、e
- (4) a、d、f
- (5) b、c、e
- (6) b、c、f
- (7) b、d、e
- (8) b、d、f
- 4) (c)の方法で$1.6\text{kg}$の硫黄をすべて硫酸にしたとすると96%硫酸は何$\text{kg}$できるか。 四捨五入により小数第1位まで求め、数値を入れよ。
$\fbox{ネ}.\fbox{ノ}\text{kg}$
- 1) $\fbox{タ}$~$\fbox{ト}$には【A群】から、$\fbox{ナ}$には【B群】から最も適するものを一つずつ選べ。重複して選んでよい。
- (9) 正しいのはどれか。一つ選べ。$\fbox{ハ}$
- (1) エタノールに濃硫酸を加え170℃で熱するとジエチルエーテルが生じる。
- (2) アニリンはアルカリ性水溶液によく溶ける。
- (3) 第一級アルコールを酸化するとケトンが生じる。
- (4) エチルメチルエーテルは2-プロパノールの構造異性体である。
- ジエチルエーテル溶液中のフェノールとトルエンは酸性水溶液を加えて分離できる。
- (10) 下線部が誤っているのはどれか。一つ選べ。$\fbox{ヒ}$
- (1) デンプンではグルコースが$\underline{\alpha型で結合している}$。
- (2) セルロースを完全に加水分解するとセロビオースが得られる。
- (3) スクロースは銀鏡反応を示さない鏡反応を示さない。
- (4) 油脂を構成する高級脂肪酸には、炭素原子間の二重結合を複数もつものがある。
- (5) 加水分解すると3種類の脂肪酸を生じる油脂の分子には、不斉炭素原子が存在する。
- (6) 一定質量の油脂をけん化するために必要な水酸化ナトリウムの質量は、適脂の分子量に反比例する。
- (11) 次の物質$\text{a}$~$\text{c}$のそれぞれ$1\text{g}$を水に溶かして$1\text{L}$にした。それぞれの水溶液の浸透圧が大きい順に並んでいるのはどれか。一つ選べ。$\fbox{フ}$
- a グルコース(分子量180)
- b 塩化カルシウム(式量111)
- c 硝酸カリウム(式量101)
- (1) $\text{a}\gt\text{b}\gt\text{c}$
- (2) $\text{a}\gt\text{c}\gt\text{b}$
- (3) $\text{b}\gt\text{a}\gt\text{c}$
- (4) $\text{b}\gt\text{c}\gt\text{a}$
- (5) $\text{c}\gt\text{a}\gt\text{b}$
- (6) $\text{c}\gt\text{b}\gt\text{a}$
- (12) 化学式が$\text{C}_n\text{H}_{2n}$であるアルケン$7.0 \text{g}$に臭素を完全に反応させたところ、化合物$\text{C}_n\text{H}_{2n}\text{Br}_2$が$47.0\text{g}$生成した。このアルケンの炭素の数$n$はいくつか。数値を入れよ。$n=\fbox{ヘ}$
- (1) 1)、2)に当てはまるものを、それぞれ二つずつ選び、$\fbox{ア}$、$\fbox{イ}$に二つずつマークせよ。
- 各間いに答えよ。
- (l) 電気的に中性な原子において、常に原子番号と等しいのはどれか。二つ選び、$\fbox{ア}$に二つマークせよ。
- (1) 原子量
- (2) 最外殼電子の数
- (3) 陽子の数
- (4) 中性子の数
- (5) 電子の数
- (6) 質量数
- (2) 正しいのはどれか。一つ選べ。$\fbox{イ}$
- (1) 最も原子番号が小さいアルカリ土類金属元素はベリリウムである。
- (2) アルミニウムは塩酸と反応して溶けるが、水酸化ナトリウム水溶液とは反応しない。
- (3) マグネシウムは熱湯と反応して水素を発生する。
- (4) ハロゲンと水素との化合物のうちで、水溶液が最も強い酸性を示すのはフッ化水素である。
- (5) 一酸化炭素と二酸化炭素は互いに同素体の関係にある。
- (3) 誤っているのはどれか。一つ選べ。$\fbox{ウ}$
- イオン結晶では、陽イオンと陰イオンが静電気力で引き合っている。
- (2) 2原子間の結合では、電気陰性度の大きい原子に負の電荷が少し偏っている。
- (3) 分子結晶では、構成分子間にファンデルワールス力がはたらいている。
- (4) 水素結合による引力は、ファンデルワールス力による引力より強い。
- (5) $\text{HCl}$に比べて$\text{HF}$の沸点が高いのは、$\text{HF}$で強いファンデルワールス力がはたらいているためである。
- (6) 金属では、自由電子が正の電荷を帯びた金属原子を結びつけている。
- (4) 図は原子番号とイオン化エネルギーの関係を示している。図中の元素A、B、Cのすべてに当てはまる記述の組合せはどれか。 一つ選べ。$\fbox{エ}$
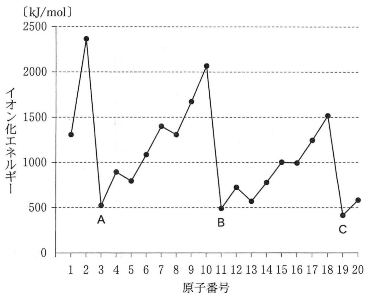
- a 金属元素である。
- b 非金属元素である。
- c 原子では価電子の数が0である。
- d 原子では最外殼電子の数が1個である。
- e 陽イオンよりも陰イオンになりやすい。
- (1) aとc
- (2) aとd
- (3) aとe
- (4) bとc
- (5) bとd
- (6) bとe
(5) $\fbox{オ}$~$\fbox{キ}$には【A群】から、$\fbox{ク}$には【B群】から、$\fbox{ケ}$、$\fbox{コ}$には【C群】から適するものを一つずつ選べ。
図のような電解槽を用いて、塩化ナトリウム水溶液に電極を入れ、電気分解を行うと、陽極に$\fbox{オ}$、陰極に$\fbox{カ}$が生成し、陰極付近の水溶液中では$\text{Na}^+$と$\fbox{キ}$の濃度が大きくなる。$\fbox{オ}$と$\fbox{カ}$は、$9.65\times10^4$クーロンの電気量によって、ともに$\fbox{ク}\text{mol}$が生成する。Aアンペアの電流をT分間通じたときの電気量は$\fbox{ケ}$クーロンであり、生成する$\fbox{オ}$と$\fbox{カ}$の体積は、標準状態でそれぞれ$\fbox{コ}$リットルである。
【A群】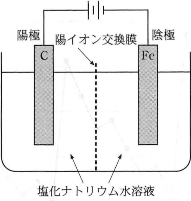
- (1) $\text{OH}^-$
- (2) $\text{Cl}^-$
- (3) $\text{O}_2$
- (4) $\text{Cl}_2$
- (5) $\text{H}_2$
- (1) 0.25
- (2) 0.5
- (3) 1
- (4) 2
- (5) 4
- (1) $3.5\times10^{-3}AT$
- (2) $7.0\times10^{-3}AT$
- (3) $1.4\times10^{-2}AT$
- (4) $60AT$
- (5) $160AT$
- (6) $360AT$
- (7) $\dfrac{9.0 \times10^3}{AT}$
- (8) $\dfrac{1.8\times10^4}{AT}$
- (9) $\dfrac{3.6\times10^4}{AT}$
- (6) 正しいのはどれか。一つ選べ。ただし、溶液の温度は25℃とする。$\fbox{サ}$
- (1) $0.1\text{mol/L}$の酢酸水溶液のpHが3.0のとき、この酢酸の電離度は0.1である。
- (2) $2\times10^{-4}\text{mol/L}$の希硫酸のpHは4.3である。
- (3) pHが13の水酸化ナトリウム水溶液を水で100倍に希釈した水溶液のpHは10である。
- (4) pHが5の酢酸水溶液$1\text{L}$と$0.01\text{mol/L}$の塩酸$1\text{mL}$は同数の水素イオンを含む。
- (5) $0.1\text{mol/L}$の硫酸$16.0\text{mL}$に、$0.1\text{mol/L}$の水酸化ナトリウム水溶液$34.0\text{mL}$を混合した溶液のpHは9.6である。
- (7) 不斉炭素原子をもつ鎖式飽和炭化水素の分子式を$\text{C}_x\text{H}_y$とするとき、$y$の最小値はいくらか。数値を入れよ。$y=\fbox{シ}\fbox{ス}$
- (8) 反応の種類と反応の組合せで誤っているのはどれか。一つ選べ。$\fbox{セ}$
- (1) 還 元: 二トロベンゼン$\longrightarrow$アニリン
- (2) エステル化: アニリン$\longrightarrow$アセトアニリド
- (3) 分子内脱水: フタル酸$\longrightarrow$無水フタル酸
- (4) 置 換: フェノール$\longrightarrow$2,4,6-トリブロモフェノール
- (5) 付 加: アセチレン$\longrightarrow$塩化ビニル
- (9) 分子式$\text{C}_2\text{H}_6\text{O}$の化合物$2.3\text{g}$と標準状態で$4.48\text{L}$の酸素を$20.0\text{L}の真空の容器に入れ、完全燃焼させた。$\fbox{ソ}$~$\fbox{ト}$に適する数値を入れよ。 ただし、解答は四捨五入により有効数字2桁で求めよ。
- 1) 燃焼後、容器内に残っている酸素は何$\text{g}$か。$\fbox{ソ}.\fbox{タ}\text{g}$
- 2) 燃焼後に容器内の温度を127℃に保った。全体の圧力は何$\text{Pa}$か。ただし、127℃における飽和水蒸気圧は、$2.5\times10^5\text{Pa}$である。
$\fbox{チ}.\fbox{ツ}\times10^{\fbox{テ}\fbox{ト}}\text{Pa}$
(10) $\fbox{ナ}$~$\fbox{ネ}$に適する数値を入れよ。ただし、解答は四捨五入により、整数で求めよ。
ある化合物Xの水に対する溶解度(水$100\text{g}$に溶けることができる溶質の質量($\text{g}$)の数値)は90℃で70、20℃で37である。この化合物の20℃における飽和水溶液の質量パーセント濃度は$\fbox{ナ}\fbox{ニ}$%である。この飽和水溶液$100\text{g}$を90℃まで加熱すると、さらに$\fbox{ヌ}\fbox{ネ}\text{g}$を溶解させることができる。
- (11) 珊瑚礁の炭酸カルシウムは、サンゴ虫などの生物が海水中のカルシウムイオンを固定してつくったものである。この炭酸カルシウムは、ほぼ中性である海水中で、大気中から溶け込んだ二酸化炭素、水に溶けているカルシウムイオン、炭酸水素イオンなどの間で次の平衡状態になっている。
\[\text{CaCO}_3+\text{H}_2\text{0}+\text{CO}_2\leftrightarrows\text{Ca}^{2+}+2\text{HCO}_3^-\]
この平衡に関する記述a~cの下線部について、正誤の組合せが正しいのはどれか。一つ選べ。$\fbox{ノ}$
- a 大気中の二酸化炭素が海水中に溶け込むと、カルシウムイオンから炭酸カルシウムが生成する。
- b 海水中のカルシウムイオンが炭酸カルシウムとして固定されると、二酸化炭素が生成する。
- c 海中の植物などの光合成によって二酸化炭素が消費されると、炭酸カルシウムが生成する。
a b c (1) 正 正 正 (2) 正 正 誤 (3) 正 誤 正 (4) 正 誤 誤 (5) 誤 正 正 (6) 誤 正 誤 (7) 誤 誤 正 (8) 誤 誤 誤
- (12) 問いに答えよ。
1) $\fbox{ハ}$~$\fbox{フ}$に最も適するものを一つずつ選べ。重複して選んでよい。
タンパク質を加水分解したとき、アミノ酸だけが得られるタンパク質を$\fbox{ハ}$タンパク質という。これに対して、アミノ酸以外の物質、たとえば糖質や脂質、色素なども同時に生じるタンパク質を$\fbox{ヒ}$タンパク質という。赤血球に存在するヘモグロビンは$\fbox{フ}$タンパク質の一つである。
- (1) 陽性
- (2) 陰性
- (3) 中性
- (4) 変性
- (5) 同種
- (6) 異種
- (7) 単純
- (8) 複合
2) $\fbox{ヘ}$、$\fbox{マ}$には【A群】から、$\fbox{ホ}$、$\fbox{ミ}$には【B群】から、最も適するものを一つずつ選べ。
タンパク質を構成するアミノ酸は$\fbox{ヘ}$種類知られている。これらのアミノ酸にはグリシンを除いて、$\fbox{ホ}$炭素に$\fbox{マ}$種類の異なる原子や原子団が結合しているので、$\fbox{ミ}$異性体が存在する。
【A群】- (1) 1
- (2) 2
- (3) 3
- (4) 4
- (5) 5
- (6) 6
- (7) 10
- (8) 20
- (9) 30
- (10) 40
- (1) $\alpha-$
- (2) $\beta-$
- (3) $\gamma-$
- (4) 幾何
- (5) 光学
- (6) 構造
3) $\fbox{ム}$、$\fbox{ヤ}$には【A群】から、$\fbox{メ}$、$\fbox{モ}$、$\fbox{ユ}$には【B群】から最も適するものを一つずつ選べ。重複して選んでよい。
グリシンを含む水溶液のpHを、酸やアルカリを加えてグリシンの等電点に一致させると、ほとんどのグリシンは$\fbox{ム}$の構造を持つ$\fbox{メ}$になっている。このとき、グリシン分子の正味の電荷は$\fbox{モ}$である。pHが等電点に一致しているグリシン水溶液に、塩酸を加えてpHを2にすると、ほとんどのグリシンは$\fbox{ヤ}$の構造を持つ$\fbox{ユ}$になる。
【A群】- (1) $\text{H}_3\text{N}^+-\text{CH}_2-\text{COOH}$
- (2) $\text{H}_2\text{N}-\text{CH}_2-\text{COOH}$
- (3) $\text{H}_2\text{N}-\text{CH}_2-\text{COO}^-$
- (4) $\text{H}_3\text{N}^+-\text{CH}_2-\text{COO}^-$
- (1) 正
- (2) 負
- (3) 0
- (4) 陽イオン
- (5) 陰イオン
- (6) 双性イオン
- (7) 塩基性アミノ酸
- (8) 酸性アミノ酸
- (l) 電気的に中性な原子において、常に原子番号と等しいのはどれか。二つ選び、$\fbox{ア}$に二つマークせよ。