近畿大学化学2013年第2問
次の問(1)~問(3)に答えよ。
- 問(1) 一酸化炭素は、実験室では1)ギ酸を機硫酸で脱水することによって生成する。水に溶け[ 1 ]ので[ 2 ]によって捕集する。工業的には、2)赤熱したコークス(黒鉛)に水蒸気を触れさせることによって生成する。この反応の反応熱および一酸化炭素の生成熱は、次の熱化学方程式から求めることができる。以下の設問(a)~(d)に答えよ。
\[\text{C}(黒鉛)+\text{O}_2=\text{CO}_2+394\text{kJ}\]
\[\text{CO}+\dfrac{1}{2}\text{O}_2=\text{CO}_2+283\text{kJ}\]
\[\text{H}_2+\dfrac{1}{2}\text{O}_2=\text{H}_2\text{O}(気)+242\text{kJ}\]
- (a)[ 1 ]、[ 2 ]に当てはまる最も適切な語句を答えよ。
- (b)下線部1)の過程により一酸化炭素1molが生成する反応の反応式を示せ。
- (c)下線部2)の過程により一酸化炭素1molが生成する反応の熱化学方程式を示せ。
- (d)一酸化炭素の生成熱はいくらか。
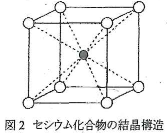
- 問(2) セシウムと他の1種類の元素からなる化合物の結晶を調べたところ、密度が4.00g/cm3であり、図2に示すように、一辺が0.412nmの立方体を単位とする結晶構造をもつことがわかった。
- (a)この化合物の式量を計算せよ。
- (b)この式量に最も近い安定なセシウム化合物の化学式および化合物名を答えよ。
- 問(3) 次に説明するカリウムの同位体について、以下の設問(a)~(c)に答えよ。有効数字2桁で答えよ。
地球上のカリウムは、その大部分を2種類の安定同位体$^{39}\text{K}$と$^{41}\text{K}$が占め、ごくわずかに全体の約0.012%を放射性同位体$^{40}\text{K}$(カリウム40)が占める。$^{40}\text{K}$は、自然な核反応によって、高速の電子(ベータ線)や高エネルギーの電磁波(ガンマ線)を放出しながら、およそ9割が$^{40}\text{Ca}$へ、1割が$^{40}\text{Ar}$へと非常にゆっくりとした速度で変化し、減少している。人の体内に存在するカリウムの全量は、摂取と排出が平衡し、体重の0.20%程度によく保たれている。カリウムは動植物にとって必要不可欠な元素だが、微量に含まれる$^{40}\text{K}$は体内被爆の要因の一つとなっている。$^{40}\text{K}$の半減期は非常に長く(12.5億年)、その反応速度は、$^{40}\text{K}$の量が1兆分の1(1012分の1)だけ減少するのに15.8時間かかる速度に等しい。
- (a)体重60kgの人の体内には何molのカリウムが存在するか。
- (b)体重60kgの人の体内に存在する放射性同位体$^{40}\text{K}$は何個と見積られるか。
- (c)体重60kgの人の体内で反応して減少する$^{40}\text{K}$の数は1秒間当り何個と見積られるか(注1)。
(注1)1秒間当りの崩壊数をべクレル(記号Bq)という単位で表す。