埼玉医科大学化学2012年第2問
グリシンに関する次の文章を読み、下の問い (問1~5) に答えよ。
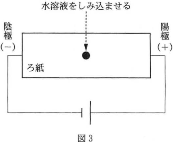
問3 図2のA、B、C、D、Eで示す各水溶液をそれぞれ、図3のように、湿らせたろ紙の中央にしみ込ませ、その両端に電極をつないで直流電圧をかけた。このときグリシンが陽極側へ移動するものはどれか。最も適切なものを次の(1)~(9)のうちから1つ選べ。$\fbox{14}$
問4 電離定数$K_1$、$K_2$を表す次の式の$\fbox{15}$~$\fbox{18}$に入る数字をそれぞれマークせよ。
\[K_1=10^{-\fbox{15}.\fbox{16}}\text{mol/L}\]
\[K_2=10^{-\fbox{17}.\fbox{18}}\text{mol/L}\]
( $\fbox{15}$と$\fbox{17}$は一の位の数字、$\fbox{16}$と$\fbox{18}$は小数第1位の数字である。小数第2位以下がある場合は四捨五入せよ。)
問5 グリシンの等電点の値は$\fbox{19}.\fbox{20}$になる。このとき、$\fbox{19}$、$\fbox{20}$に入る数字をそれぞれマークせよ。($\fbox{19}$は一の位の数字、$\fbox{20}$は小数第1位の数字である。小数第2位以下がある場合は四捨五入せよ。)
アミノ酸の1種であるグリシン$\text{H}_2\text{NCH}_2\text{COOH}$は、水溶液中で3種類のイオンⅠ、Ⅱ、Ⅲとして存在し、互いに電離平衡の状態にある(式\eqref{aa}、式\eqref{ab})。 式\eqref{aa}の電離平衡の電離定数を$K_1$、式\eqref{ab}の電離平衡の電離定数を$K_2$とする。 \[(\text{I})~\text{H}_3\text{N}^+\text{COOH}\leftrightarrows(\text{I}\hspace{-.1em}\text{I})~\text{H}_3\text{N}^+\text{CH}_2\text{COO}^-+\text{H}^+\tag{1}\label{aa}\] \[(\text{I}\hspace{-.1em}\text{I})~\text{H}_3\text{N}^+\text{CH}_2\text{COO}^-\leftrightarrows(\text{I}\hspace{-.1em}\text{I}\hspace{-.1em}\text{I})~\text{H}_2\text{NCH}_2\text{COO}^-+\text{H}^+\tag{2}\label{ab}\]
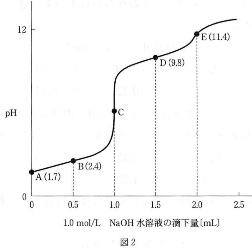
0.10 mol/Lグリシン塩酸塩$\text{CH}_2(\text{COOH}){\text{NH}_3}^+\text{Cl}^-$水溶液10.0 mLに、1.0 mol/L水酸化ナトリウム$\text{NaOH}$水溶液を滴下したときのpHの変化を図2に示す。図2で、A、B、D、E各点の( )内の数字は水溶液のpHである。

- 問1 式\eqref{aa}の電離平衡において、Ⅰの電離度をモル濃度を用いて表した式と
して最も適切なものを、次の(1)~(9)のうちから1つ選べ。$\fbox{9}$
- (1) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~]}{[~\text{I}]~}$
- (2) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~][~\text{H}^+]}{[~\text{I}~]}$
- (3) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~]+[~\text{H}^+]}{[~\text{I}~]}$
- (4) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~]}{[~\text{I}~]+[~\text{I}\hspace{-.1em}\text{I}~]}$
- (5) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~][~\text{H}^+]}{[~\text{I}~]+[~\text{I}\hspace{-.1em}\text{I}~]}$
- (6)$\dfrac{[~\text{I}\hspace{-.1em}\text{I}~]+[~\text{H}^+]}{[~\text{I}~]+[~\text{I}\hspace{-.1em}\text{I}~]}$(7) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~]}{[~\text{I}~]+[~\text{I}\hspace{-.1em}\text{I}~]+[~\text{H}^+]}$
- (8) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~][~\text{H}^+]}{[~\text{I}~]+[~\text{I}\hspace{-.1em}\text{I}~]+[~\text{H}^+]}$
- (9) $\dfrac{[~\text{I}\hspace{-.1em}\text{I}~]+[~\text{H}^+]}{[~\text{I}~]+[~\text{I}\hspace{-.1em}\text{I}~]+[~\text{H}^+]}$
- 問2 図2のB、C、D、Eで示す各水溶液中で、イオンⅠ~Ⅲが存在する割合として最も適切なものを、次の(1)~(7)のうちからそれぞれ1つずつ選べ。同じものを繰り返し選んでもよい。
- B $\fbox{10}$
- C $\fbox{11}$
- D $\fbox{12}$ E $\fbox{13}$
- (1) ほとんどがⅠとして存在する。
- (2) ほとんどがⅡとして存在する。
- (3) ほとんどがⅢとして存在する。
- (4) ほとんどがⅠとⅡで、それぞれ等量ずつ存在する。
- (5) ほとんどがⅡとⅢで、それぞれ等量ずつ存在する。
- (6) ほとんどがⅠとⅢで、それぞれ等量ずつ存在する。
- (7) ⅠとⅡとⅢがほぼ等量ずつ存在する。

- (1) Aの水溶液のみ
- (2) Bの水溶液のみ
- (3) Cの水溶液のみ
- (4) Dの水溶液のみ
- (5) Eの水溶液のみ
- (6) Aの水溶液とBの水溶液
- (7) Bの水溶液とCの水溶液
- (8) Cの水溶液とDの水溶液
- (9) Dの水溶液とEの水溶液