帝京大学化学2013年第3問
一般に、水より沸点の高い不揮発性溶質を溶かした水溶液の蒸気圧は水に比べて[ A ]くなる。そのため、一定の大気圧の下では水溶液の沸点は水より[ B ]くなる。一方、水溶液中の水が凝固し始める温度は水の凝固点より低くなり、この現象を凝固点降下という。希薄溶液の凝固点降下度は、溶質の種類によらず、溶液の質量モル濃度に比例する。溶質が電解質のときには、電離後のイオンを含むすべての溶質の質量モル濃度に比例する。溶質の濃度が1mol/kgであるときの溶液の凝固点降下度をモル凝固点降下といい、溶媒に固有の値である。水は固体(氷)、液体(水)、気体(水蒸気)の3つの状態を取る。右図はそれらの3つの状態の圧力(hPa=102Pa)と温度(℃)の関係を示したものである。図中のⅠは[ C ]、Ⅱは[ D ]、Ⅲは[ E ]の状態で存在する領域である。実線──は[ F ]の、破線╌╌╌は[ G ]の状態図を表している。この図中で、水と水溶液の、蒸気圧の差は[ H ]、沸点の差は[ I ]、凝固点の差は[ J ]で表される。
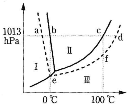

- 問1 文中の空欄[ A ]、[ B ]には[高、低]、空欄[ C ]~[ E ]には[気体、液体、固体]、空欄[ F ]、[ G ]には[水、水溶液]、空欄[ H ]~[ J ]には図中の線分[ab、be、cd、cf]のどれかがあてはまる。[ ]内のあてはまる語または記号を解答欄に記入しなさい。
- 問2 ヒトの血液(血清)と等張の(浸透圧の等しい)ブドウ糖(グルコース)溶液をつくるとき、水100gに対して必要なブドウ糖(グルコース)(分子量180)は何gか、最も近い値を選び、ア~オの記号で答えなさい。ただし、水のモル凝固点降下は1.86、血液(血清)の凝固点降下度は0.52である。
- ア)4.96
- イ)5.00
- ウ)5.04
- エ)5.08
- オ)5.12
- 問3 分子量242の薬品を水に溶かして、血液(血清)と等張の注射液をつくりたい。この薬品1モルは水に溶けると、1モルの陽イオンと1モルの陰イオンに解離する。その電離度が0.80であるとして、以下の問いに答えなさい。ただし、水のモル凝固点降下および血液(血清)の凝固点降下度は問2の値を用いなさい。
- a)この薬品1モルは水に溶けると、そのイオンを含めた全モル数は何モル(mol)になるか、最も近い値を選び、ア~オの記号で答えなさい。
- ア)1.60
- イ)1.65
- ウ)1.70
- エ)1.75
- オ)1.80
- b)血液(血清)と等張の注射液をつくるためには、1.000gの水に何モルの薬品を溶かせばよいか、最も近い値を選び、ア~オの記号で答えなさい。
- ア)0.150
- イ)0.156
- ウ)0.162
- エ)0.168
- オ)0.174
- c)水100gにこの薬品何gを溶かせばよいか、最も近い値を選び、ア~オの記号で答えなさい
- ア)3.52
- イ)3.65
- ウ)3.72
- エ)3.77
- オ)3.82
- a)この薬品1モルは水に溶けると、そのイオンを含めた全モル数は何モル(mol)になるか、最も近い値を選び、ア~オの記号で答えなさい。
- 問4 ブドウ糖(グルコース)(分子量180)27gと塩化ナトリウム(式量58.5)で血液(血清)と等張な液を1,000gつくるとき、必要な塩化ナトリウムの量は何gか、最も近い値を選びア~オの記号で答えなさい。ただし、塩化ナトリウムは完全に電離しているものとし、水のモル凝固点降下および血液(血清)の凝固点降下度は問2の値を用いなさい。
- ア)3.80
- イ)3.90
- ウ)4.10
- エ)5.70
- オ)7.60