福岡大学化学2013年第2問
次の文を読み、下の問1~問8に答えよ。
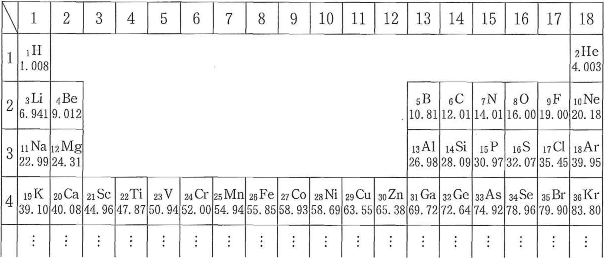
元素を原子番号の小さいものから順に並べると、性質のよく似た元素が一定の間隔で周期的に現れる。このように元素の性質が周期的に変化することを周期律という。性質のよく似た元素が同じ縦の列に並ぶように組んだ表が周期表である。周期表の縦の列を族、横の行を周期という。次の表は、現在国際的に用いられている周期表の一部を示している。

- 問1 現在用いられている周期表では、周期の数はいくつあるか。次の(1)~(5)から選び、番号で答えよ。
- (1)6
- (2)7
- (3)8
- (4)9
- (5)10
- 問2 次の文中の$\fbox{*}$に最も適する語句を解答欄に記入せよ。
世界最初の周期表は、1869年にロシアの化学者メンデレーエフが元素を原子量の順に並べることにより作成した。しかし、上の周期表において、$_{18}\text{Ar}$と、$_{19}\text{K}$や$_{27}\text{Co}$と$_{28}\text{Ni}$は原子量の順に並んでいない。この理由は、原子番号が小さい方の元素に質量数の大きな$\fbox{*}$が多く存在するためである。
- 問3 16族元素の水素化物の沸点は、第2周期の元素が最も高い。その要因として最も関連性の低いものはどれか。次の(1)~(5)から選び、番号で答えよ。
- (1)第2周期の元素と水素原子の電気陰性度の差が最も大きい。
- (2)第2周期の元素の水素化物の分子量が最も小さい。
- (3)第2周期の元素と水素原子の結合の極性が最も大きい。
- (4)第2周期の元素の水素化物では、隣り合う分子が水素結合で結ばれている。
- (5)第2周期の元素の水素化物では、隣り合う分子が静電気的な引力で結ばれている。
- 問4 次の化合物(1)~(5)のうち、構成原子間の結合に働く力が、(a)最もイオン結合性の高いもの、および(b)最も共有結合性の高いものはどれか。それぞれ番号で答えよ。ただし、電気陰性度の値を$\text{Na}=0.9$、$\text{Li}=1.0$、$\text{Mg}=1.2$、$\text{H}=2.1$、$\text{N}=3.0$、$\text{O}=3.5$、$\text{F}=4.0$とする。
- (1)$\text{Li}_3\text{N}$
- (2)$\text{MgO}$
- (3)$\text{LiF}$
- (4)$\text{NH}_3$
- (5)$\text{NaH}$
- 問5 次のイオン(1)~(5)のうち、(a)イオン半径が最も大きいもの、および(b)イオン半径が最も小さいものはどれか。それぞれ番号で答えよ。
- (1)$\text{Na}^+$
- (2)$\text{Mg}^{2+}$
- (3)$\text{Al}^{3+}$
- (4)$\text{O}^{2-}$
- (5)$\text{F}^-$
- 問6 イオン化エネルギーに関する次の記述(a)~(e)のうち、正しいものの組み合わせはどれか。下の(1)~(8)から選び、番号で答えよ。
- (a)イオン化エネルギーとは、中性の原子を陽イオンまたは陰イオンにするのに要するエネルギーをいう。
- (b)同族元素においては、一般に原子の大きさが大きいほどイオン化エネルギーは小さい。
- (c)イオン化エネルギーの大小とその元素の陽性や陰性とは無関係である。
- (d)第n次と第(n+1)次のイオン化エネルギーの値に大きな差があるとき、その典型元素の最外殼電子数はn個である。
- (e)金属原子のイオン化エネルギーの大小とイオン化傾向の大小とは同順である。
- (1)aとb
- (2)aとc
- (3)aとd
- (4)aとe
- (5)bとc
- (6)bとd
- (7)cとe
- (8)dとe
- 問7 17族元素の水素化物の中で弱酸はどれか。次の(1)~(4)から選び、番号で答えよ。
- (1)$\text{HF}$
- (2)$\text{HCl}$
- (3)$\text{HBr}$
- (4)$\text{HI}$
- 問8 ある一価の弱酸0.010mol/L水溶液の25℃でのpHを有効数字3桁で答えよ。ただし、弱酸の電離度は1に比べて極めて小さく、25℃におけるこの弱酸の電離定数$K_a$を$6.8\times10^{-4}$mol/L、$\log_{10}6.8=0.83$とする。