北里大学化学2013年第4問
次の文章を読み、[1]~[4]の問に答えよ。答は各問の(1)から始まる選択肢の中から選べ。
アンモニア水溶液中では、アンモニアの一部が水と反応し、次式の電離平衡が成立している。 \[\text{NH}_3+\text{H}_2\text{O}\rightleftarrows\text{NH}_4{^+}+\text{OH}^-\tag{1}\] アンモニアの電離定数$Kb$は次式で表される。 \[Kb=\dfrac{[\text{NH}_4{^+}][\text{OH}^-]}{[\text{NH}_3]}\tag{2}\label{ac}\] ここで、記号[ ]はモル濃度を示す。
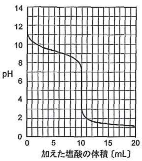
右図は、25℃で0.20mol/Lアンモニア水溶液10mLを0.20mol/L塩酸で滴定したときの滴定曲線であり、いくつかの測定点での結果を下表に示した。
なお、水溶液の温度は常に25℃に保たれ、水のイオン積$K_w$は$1.0\times10^{-14}$mol2/L2、アンモニアの電離度は1よりも十分小さいものとする。

- [1]この滴定に適したpH指示薬と、中和点の前後における水溶液の色の変化について、正しい組み合わせはどれか。$\fbox{18}$
- (1)メチルレッド、黄色から赤色
- (2)メチルレッド、赤色から無色
- (3)メチルオレンジ、赤色から黄色
- (4)メチルオレンジ、黄色から無色
- (5)フェノールフタレイン、赤色から無色
- (6)フェノールフタレイン、無色から赤色
- [2]次の関係式のうちから、この滴定の中和点において成り立つものをすべて選べ。$\fbox{19}$
- a.$[\text{H}^+]=[\text{OH}^-]$
- b.$[\text{NH}_4{^+}]=[\text{OH}^-]$
- c.$[\text{NH}_3]+[\text{NH}_4{^+}]=[\text{Cl}^-]$
- d.$[\text{NH}_4{^+}]+[\text{H}^+]=[\text{Cl}^-]+[\text{OH}^-]$
- (1)a
- (2)b
- (3)c
- (4)d
- (5)a、b
- (6)a、c
- (7)a、d
- (8)b、c
- (9)b、d
- (10)c、d
- [3]0.20mol/Lアンモニア水溶液におけるアンモニアの電離度はいくらか。$\fbox{20}$
- (1)$5.0\times10^{-2.7}$
- (2)$2.0\times10^{-3.7}$
- (3)$5.0\times10^{-5.1}$
- (4)$5.0\times10^{-8.9}$
- (5)$5.0\times10^{-11.3}$
- (6)$2.0\times10^{-12.3}$
- [4]$\eqref{ac}$式より、アンモニアのモル濃度とアンモニウムイオンのモル濃度が等しいとき、水酸化物イオンのモル濃度はアンモニアの電離定数$Kb$の値と等しくなる。この中和滴定において、その条件が成り立つのは塩酸を( ア )mL加えたときであり、そのときの水溶液のpHからアンモニアの電離定数は( イ )mol/Lと求められる。空欄( ア )、( イ )に当てはまるものが順に並んでいるものはどれか。$\fbox{21}$
- (1)$2.5、10^{-4.2}$
- (2)$2.5、10^{-9.8}$
- (3)$5.0、10^{-4.7}$
- (4)$5.0、10^{-9.3}$
- (5)$7.5、10^{-5.2}$
- (6)$7.5、10^{-8.8}$
- (7)$10.0、10^{-5.9}$
- (8)$10.0、10^{-5.1}$
- (9)$15.0、10^{-1.4}$
- (10)$15.0、10^{-12.6}$