日本医科大学化学2013年第2問
下の図は、ある気体の反応(1)について、反応経路とエネルギーの関係を示したものである。
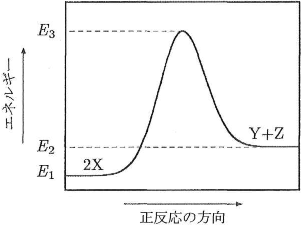

図の中の$E_1$は反応(1)の反応物(2X)がもつエネルギー、$E_2$は生成物(Y+Z)がもっエネルギー、$E_3$は活性化状態のエネルギーである。この反応の正反応と逆反応の速度定数を、それぞれ$k_f$および$k_r$とし、活性化エネルギーを$E_{af}$および$E_{ar}$とすると、 \[\log_{10}k_f=-\dfrac{E_{af}}{2.303RT}+\log_{10}A_f\] \[\log_{10}k_r=-\dfrac{E_{ar}}{2.303RT}+\log_{10}A_r\] の関係が成立する。ただし、$T$は絶対温度、$R$は気体定数、$A_F$と$A_r$は定数であり、$E_{af}$、$E_{ar}$、$A_f$、$A_r$は温度によって変化しないものとする。この反応について、図をもとにして問いに答えなさい。
- 問1 $E_{af}$を、$E_1$、$E_2$、$E_3$のうち必要な記号を用いて式で書きなさい。
- 問2 $E_{ar}$を、$E_1$、$E_2$、$E_3$のうち必要な記号を用いて式で書きなさい。
- 問3 反応熱をQとして、熱化学方程式を$X=\frac{1}{2}Y+\frac{1}{2}Z+Q$と定義すると、$Q$はどのような式で表されますか。$E_1$、$E_2$、$E_3$のうち必要な記号を用いて書きなさい。
- 問4 280Kと320Kにおいて、正反応の速度のみを測定したところ、この温度上昇によって反応速度は10.0倍に増加した。$E_{af}$は何kJ/molですか。有効数字3桁で書きなさい。
- 問5 反応(1)の濃度平衡定数$K_c$は次の式で表すことができる。 \[K_c=\dfrac{k_f}{k_r}\] この関係を用いて$\log_{10}K_c$を$T$、$R$、および問3で定義された$Q$を含む式で書きなさい。
- 問6 次のうち、反応温度を上げたときの変化として正しいものの番号をすべて書きなさい。
- 1.平衡は右に移動するが、$K_c$は変化しない。
- 2.平衡は左に移動するが、$K_c$は変化しない。
- 3.$K_c$は増加する。
- 4.$K_c$は減少する。
- 5.$k_f$と$k_r$は変化しない。
- 6.$k_f$は増加するが$k_r$は減少する。
- 7.$k_f$は減少するが、$k_r$は増加する。
- 8.$k_f$と$k_r$はともに増加するが、その増加の割合は$k_f$の方が大きい。
- 9.$k_f$と$k_r$はともに増加するが、その増加の割合は$k_r$の方が大きい。
- 10.$k_f$と$k_r$はともに減少するが、その減少の割合は$k_f$の方が大きい。
- 11.$k_f$と$k_r$はともに減少するが、その減少の割合は$k_r$の方が大きい。