産業医科大学化学2012年第1問
次の問に答えなさい。
- 問 1 ある温度において、水A [g]に、$\text{Na}_2\text{HPO}_4\cdot12\text{H}_2\text{O}$は最大B [g]溶ける。分子量は、$\text{Na}_2\text{HP}_4=$C、$\text{H}_2\text{O}=$Dとし、この温度でのリン酸水素二ナトリウムの水100g当たりの溶解度をA、B、C、Dを用いた式で示しなさい。
- 問 2 ある作業環境での空気中の塩素ガス濃度を測定するために、吸収液10 mLを入れた吸収管に毎分500 mLの流量で20分間試料空気を吸引捕集した。この吸収液中の塩素のモル濃度を測定したところ、$3.0\times10^{-5}$ mol/Lであった、この作業環境中の塩素ガス濃度は何ppmか。有効数字2桁で答えなさい。ただし、試料空気採取は、27℃、大気圧で行い、塩素ガスの吸収液への捕集効率は100%であり、定量操作中の試料の損失はなく、捕集後、吸収液の体積は変化しないものとする。また、1ppm(parts per million)は$1\times10^{-6}$ L/Lとする。
- 問 3 硫酸酸性条件下で、$2.5\times10^{-2}$ mol/Lシュウ酸ナトリウム水溶液6.0 mL中のすべてのシュウ酸イオンを酸化するために必要な$5.0\times10^{-3}$ mol/Lの過マンガン酸カリウム水溶液の体積を求めなさい。このときの酸化還元反応は、以下のとおりである。 \[ \text{C}_2{\text{O}_4}^{2-}\rightarrow2\text{CO}_2+2\text{e}^- \\ {\text{MnO}_4}^-+8\text{H}^++5\text{e}^-\rightarrow\text{Mn}^{2+}+4\text{H}_2\text{O} \]
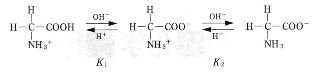
- 問 4 グリシンは、水溶液中では下式のように陽イオン、双性イオンおよび陰イオンが電離平衡状態にあり。その存在割合は水溶液のpHによって変化する、電離定数$K_1$は$4.0\times10^{-3}$ mol/L、等電点は6.0である、電離定数$K_2$を求めなさい。
問 5 難溶性の塩の生成反応を利用して、塩化物イオン$\text{Cl}^-$を定量することができる。原理は以下のとおりである。少量の$\text{K}_2\text{CrO}_4$の存在下で、$\text{Cl}^-$を含む試料溶液を濃度既知の$\text{AgNO}_3$溶液で滴定すると、初めに$\text{AgCl}$の白色沈殿が生じる。$\text{Cl}^-$がほとんどなくなると、$\text{Ag}^+$は次に${\text{CrO}_4}^{2-}$と反応して$\text{Ag}_2\text{CrO}_4$の赤褐色沈殿を形成する、この時が終点である。
この滴定で起こる反応は、 \[ \text{Ag}^++\text{Cl}^-\rightarrow\text{AgCl}~~~(白色沈殿) \\ 2\text{Ag}^++{\text{CrO}_4}^{2-}\rightarrow\text{Ag}_2\text{CrO}_4~~~(赤褐色沈殿)であり、 \] $\text{AgCl}$と$\text{Ag}_2\text{CrO}_4$の溶解度積は、それぞれ、$K_{\text{sp(AgCl})}=1.8\times10^{-10}(\text{mol/L})^2$、 $K_{\text{sp(Ag}_2\text{CrO}_4)}=2.0\times10^{-12}(\text{mol/L})^3$である。滴定の終点では、$\text{AgCl}$と$\text{Ag}_2\text{CrO}_4$とが共存し、それぞれの電離平衡が同時に成立する。この滴定で$\text{Ag}_2\text{CrO}_4$が沈殿し始める時の試料溶液中の$\text{Cl}^-$のモル濃度はいくらになるか。有効数字2桁で答えなさい。ただし、滴定終点で${\text{CrO}_4}^{2-}$の濃度は$5.0\times10^{-3}$ mol/Lとする。