東京慈恵会医科大学化学2013年第1問
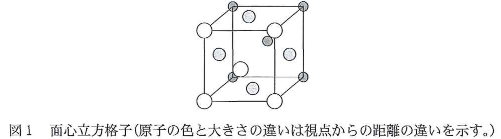
18族元素は$\fbox{A}$と呼ばれ、単原子で分子として存在する(1)一般的には化学的に不活性な元素である。安定な分子を構成する原子やイオンは、最外殼電子配置として$\fbox{A}$と等電子構造をもつ。しかし、第3周期以降の元素の化合物中の原子は、リン酸や硫酸の例からもわかるように、必ずしも18族元素の電子配置をとらないこともある。第5周期の18族元素であるキセノン$(\text{Xe})$の固体は、圧力101.3kPa、温度161Kで融解し、その融解熱は2.29kJ/molである。さらに、同圧力、温度165Kで沸騰し、その蒸発熱は12.61kJ/molである。また、キセノン(固)の単位格子は面心立方格子(図1)であり、単位格子内に含まれる原子数は$\fbox{a}$個、単位格子内に含まれる分子間結合の数は$\fbox{b}$である(図1において、最も短い原子間距離の2原子間において分子間結合が存在する)。したがって、圧力一定の条件で気体および液体のキセノンの比熱容量(物質1molあたりの比熱)がいずれも20J/(mol・K)で等しいとすると、圧力が一定のとき、気体の膨張には圧力(Pa)×体積増加量(m3)に相当するエネルギー(J)を必要とするので、101.3kPa、161Kで固体のキセノン原子2個の間に働く分子間力のエネルギーを計算すると$\fbox{c}$kJ/molとなる。
キセノンは18族元素の一種であるが、(2)化学的にきわめて安定であるというわけではない。18族元素には反応性がないと信じられていたため、その化学反応の研究はあまり進まなかったが、1962年、アメリカのバートレットにより、初めてキセノンの化学反応が報告されると、すぐに、ドイツのホッペは、キセノン(気)と酸化剤であるフッ素(気)を混合して光照射するとフッ化キセノン(Ⅱ)が生成することを報告した。この反応では、フッ素(気)の分圧を高めることで、フッ化キセノン(Ⅳ)やフッ化キセノン(Ⅵ)が生成する。これら三種類の化合物はいずれも室温で固体の化合物である。反応はいずれも発熱反応で、例えば、フッ化キセノン(Ⅳ)の熱化学方程式は、$\text{F}_2$(気)の解離エネルギーが158kJ/molなので、 \[\text{Xe}(気)+4\text{F}(気)=\text{XeF}_4(気)+532\text{kJ}\] である。また、$\text{XeF}_4$(固)の昇華熱は62kJ/molである。
- 問1 空欄Aに入る適切な語句を答えよ。また、空欄 a b cに入る適切な数字を答えよ。ただし、cでは、固体の体積は0m3と考えよ。
- 問2 1molの固体のキセノンを圧力101.3kPaで温度100Kから200Kの範囲で加熱した時に加えた熱量(kJ)と温度(K)の関係のグラフを概略して描け。ただし、固体のキセノンの比熱容量を液体のときの2分の1であるとし、横軸を加えた熱量、縦軸を温度とすること。また、縦軸、横軸には、温度と熱量の関係がわかるように適当に目盛と数値を付けること。
- 問3
- (1)下線部(1)、ヘリウムやネオンが化学反応性に乏しい理由を30字以内で述べよ。
- (2)下線部(2)、キセノンがヘリウムやネオンに比べて化学反応性が高いことと最も関係が深いものは以下のどれか、記号で答えよ。
- (a)キセノンの沸点は、ヘリウム(沸点:4K)やネオン(沸点:27K)よりかなり高い。
- (b)キセノンの電子配置はヨウ化物イオンの電子配置と等しい。
- (c)キセノンの電子親和力はカリウムのそれより小さい。
- (d)キセノンのイオン化エネルギーは塩素のそれより小さい。
- (e)気体のキセノンの原子半径は、$\text{XeF}_2$分子中のキセノン原子に比べて約2倍である。
- 問4 $\text{Xe}$(気)と$\text{F}_2$(気)から固体のフッ化キセノン(Ⅳ)が生成する際の熱化学方程式を書け。